|
|
|||||||||||||
| 价电子与原子实 |
 |
||||||||||||
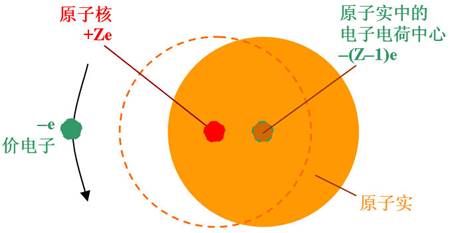
| 价电子一般是指原子最外层能参加化学键的电子。 原子实就是指原子中除价电子外的其余部分(如锂的原子实由其原子核和核外两个电子构成,钠的原子实由其原子核和核外10个电子构成,其余类推)。 碱金属原子最外层只有一个电子,属于单价电子体系。可看成由一个价电子与原子实组成。 单价原子的结构与氢原子有类似之处。当原子中只有价电子的能量发生变化时,“原子的能量”常常是指其价电子的能量。 |
|||||||||||||
|
|
|||||||||||||
|
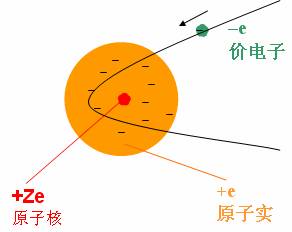
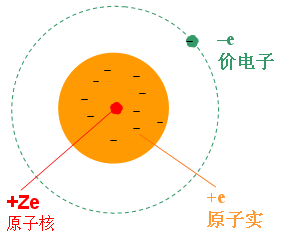
碱金属原子一切内层电子都沿着对称的轨道绕核运动,因而平均说来,可以认为它们的电荷均匀分布在以原子核为中心的一个或几个半径不同的球面上,负电荷中心重叠在原子中心(即正电荷中心),对于处在最外层的价电子来说,它们起着对原子核的正电荷屏蔽的作用。 因此,我们可以近似地假定这Z-1个电子与原子核一起构成一个带有正电荷+e的“整体”(原子实)。 显然,对于这种情况,屏蔽常数就是Z-1,有效核电荷 ,而这里的所谓“整体”就是上述所定义的“原子实”,只不过是从电特性的等效角度看问题而已。 由此可见,从电传性的等效角度看,“原子实”可等效于一个原子核,此原子核的核电荷就是有效核电荷 。 有效核电荷 Z* = Z-σ |
影响 σ 因素
|
||||||||||||
|
|||||||||||||