原子核式结构模型 |
|
|
|
英国物理学家,生于新西兰,长期在英国工作。在原子结构和放射性研究方面做出了重要的贡献。 1899年发现放射性辐射中的两种成分,并由他命名为α射线和β射线,接着又发现新的放射性元素“钍”。 1902年与英国化学家素第一起提出原子自然蜕变理论。 1911年根据 α 粒子的散射实验(卢瑟福实验)最先发现原子核的存在,并提出了关于原子结构的行星模型。 1919年用 α 粒子轰击氮原子而获得氧的同位素,第一次实现了元素的人工嬗变。 |
| 卢瑟福开始也相信老师汤姆逊的模型。 但是,卢瑟福在1910年指导其助手研究 α 粒子的性质时却发现了意料不到的新事实,实验的结果与汤姆逊的模型发生矛盾。 出于对科学真理的追求,卢瑟福对汤姆逊模型提出了怀疑和挑战,并努力通过实验寻求真正的科学理论。在随后的 实验中,卢瑟福发现发射出去的 α 粒子,有99.99%顺利穿透金箔,而0.01%(万分之一)发生了“散射”现象,卢瑟福认为,带正电的 α 粒子碰到原子时的散射,只能用原子中有一个虽微小而质量却很大的带正电的核的斥力来解释。 |
|
|
|
|
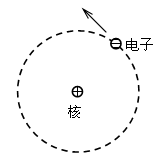
| (1)在原子的中心有一个很小的核,叫原子核,原子核的体积比原子的体积小得多。 (2)原子核集中了原子中全部的正电荷,几乎占有原子的全部质量。 (3)带负电的电子在核外空间里绕着核旋转。 也有人称之为“行星”模型,电子绕原子核运动就如同行星绕太阳转动一样。 |
|
|
|
最简单的氢原子的卢瑟福模型如图所示,核外仅有一个电子,氢原子的原子核带有电荷+e,其质量约为电子的1840倍,称为质子。 电子在核的周围绕核转动,核的半径(数量级为10-14m )较原子的半径(数量级为10-10m )小得多。 |
| 从这个模型导出的结论同实验结果符合的很好,很快就被公认了。 该模型能够很好的解释 α 粒子散射实验,但在解释光谱等问题的时候却遇到了困难......
|
|